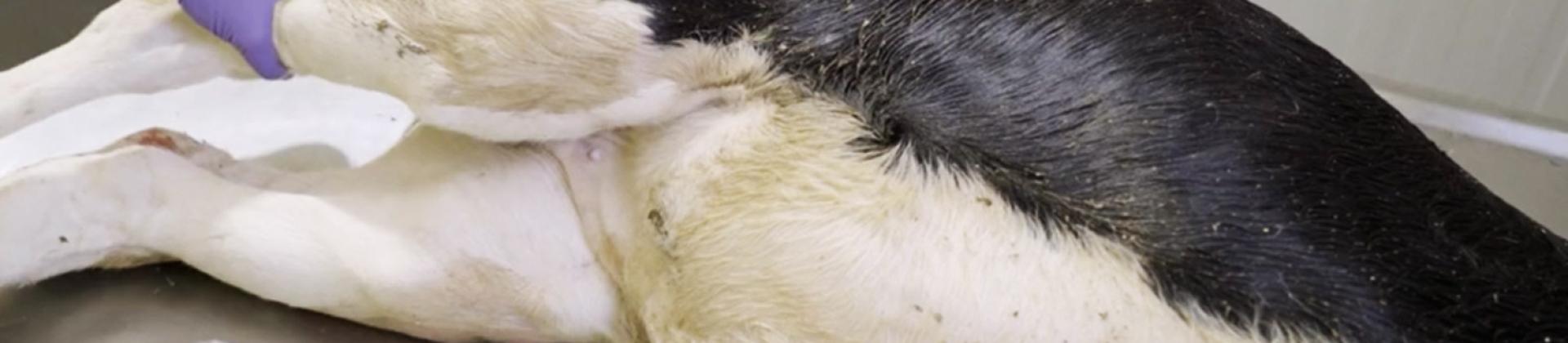
1. Coloque o cadáver em decúbito lateral esquerdo.
A posição é importante no caso dos ruminantes, uma vez que o volume do rúmen é grande e pode dificultar o exame da cavidade abdominal no caso de ser necessário aceder à mesma.
2. Abra a articulação do joelho para examinar as cápsulas sinoviais.
Quando for feita uma incisão numa articulação saudável, a presença de líquido sinovial é mínima. Se existir suspeita de sinovite, deve ser colhida uma amostra do líquido sinovial por forma a investigar a possível presença de Mycoplasma bovis ou Histophilus somni, os agentes patogénicos respiratórios que tendem a colonizar estes tecidos.
3. Disseque a pata da frente direita.
Faça uma incisão na axila, na ligação do músculo da pata, ao mesmo tempo que o membro é abduzido, até conseguir aceder facilmente ao tórax.
4. Exponha a traqueia até à faringe.
Retire a traqueia completamente, incluindo a faringe, para que todo o trato respiratório possa ser subsequentemente removido.
5. Abra até às costelas.
Faça incisões longas até aos espaços intercostais, assegurando que o pulmão não é danificado. Corte ao longo da linha do esterno, o que permitirá abrir a cavidade torácica. Em animais mais velhos, pode ser necessário um martelo para cortar ao longo da linha do esterno. Parta as costelas manualmente, abra a cavidade até o pulmão ficar exposto.
Neste momento, conseguimos observar o aspeto do pulmão e da pleura visceral e parietal. Também conseguiremos verificar se existe algum líquido anormal na cavidade.
6. Remova o trato respiratório.
Remova o trato respiratório totalmente, da faringe aos pulmões. Coloque-o numa superfície limpa, o que lhe permitirá manipular os órgãos facilmente.
7. Inspecione o tecido pulmonar.
Utilize a tesoura para fazer vários cortes profundos no parênquima pulmonar, junto à linha que separa o tecido saudável do tecido não saudável. Repita este procedimento na área afetada, a uma distância de 1 ou 2 cm das incisões anteriores. Colha amostras raspando vigorosamente com os esfregaços no interior de cada incisão por forma a detetar a presença de vírus e bactérias. Pequenas amostras de tecido afetado podem ser cortadas e colocadas num frasco para ser enviado para o laboratório.
8. Verifique a presença de abcessos ou outras lesões na faringe.
9. Abra a traqueia até à bifurcação.
Observe a presença de lesões e recolha amostras esfregando vigorosamente com um esfregaço para procurar a presença de vírus, tais como o Bovine Herpesvirus I (IBR), com uma grande afinidade para este órgão.
10. Corte o miocárdio em tiras.
Faça várias incisões para revelar a presença de enfartes, abcessos ou miocardites, indicadores de possível infeção por Histophilus somni. Caso exista esta suspeita, podem ser colhidas amostras com um esfregaço para PCR.