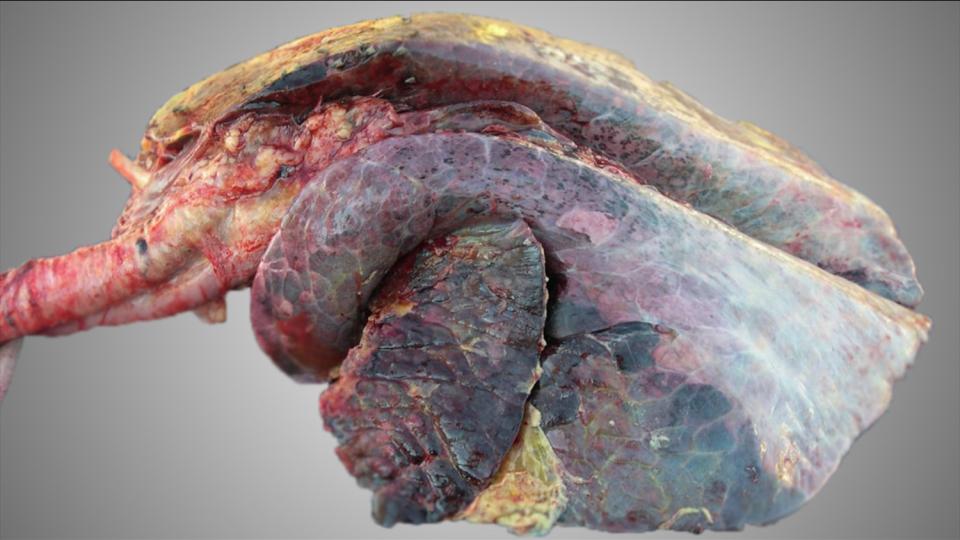
Teniendo en cuenta que el control del VDVB, a diferencia de otras enfermedades infecciosas implicadas en la ERB, es altamente factible en los sistemas de producción del ganado bovino y existen herramientas eficaces para romper el ciclo de transmisión de la enfermedad, se recomienda encarecidamente establecer el estado de ERB del rebaño: si hay evidencia de infección por VDVB.
En vacas lecheras, los procedimientos del cribado para establecer indicios de infección activa por VDVB se basan en el uso de la serología en un número representativo de animales jóvenes (de 9 a 12 o 18 meses de edad); este enfoque proporciona una indicación de infección persistente o reciente. Si el nivel de anticuerpos contra el virus de la DVB es negativo en todas las muestras, es muy probable que no hayan estado expuestos recientemente al VDVB. La PCR también se puede realizar en leche de tanque a granel para la detección de la circulación vírica en el rebaño de ordeño. Si los resultados de las pruebas de leche a granel son positivos, el VDVB circula entre las vacas de ordeño, aunque un resultado negativo no demuestra un estado libre de VDVB.
Un segundo paso es la identificación de animales con IP individuales en explotaciones positivas para el VDVB. El análisis de las muestras de sangre combinadas por PCR es un medio racional de excluir a los grupos de animales de ser portadores del VDVB. Esta última estrategia puede realizarse en combinación con PCR en la leche a granel como procedimiento de cribado en rebaños vacunados contra el VDVB. Se recomienda la obtención de muestras y el análisis de los animales con IP también en recién nacidos para identificar de forma precoz las fuentes de infección por VDVB. Debido a la interferencia de anticuerpos en el calostro con la detección del VDVB, que podría dar resultados falsos negativos en terneros menores de 4 a 6 meses de edad, las muestras de sangre individuales por PCR o las biopsias cutáneas (muescas en orejas) por ELISA pueden proporcionar resultados de pruebas fiables (Sandvik et al., 2006). Los animales con VDVB deben volverse a someter a pruebas una vez transcurridas al menos 3 semanas, para descartar una infección transitoria (Schweizer et al., 2021).
La identificación y eliminación de los animales con IP se considera clave para el control de la DVB y tienen un efecto muy beneficioso en el bienestar del ganado bovino al prevenir las infecciones transitorias. Se han identificado los elementos centrales de las estrategias sistemáticas para controlar y eliminar el VDVB (Lindberg et al., 2006; EFSA AHAW Panel, 2017):
- La bioseguridad incluye todas las medidas destinadas a reducir la transmisión entre rebaños, con especial énfasis en la prevención de contactos con/movimientos de los animales con IP, es decir, los intercambios de ganado, las exposiciones y los contactos de animales de pasto. La eficacia de los controles de movimiento es más eficaz en el contexto del control sistemático a nivel regional y nacional. El papel de las vacunas en el control sistemático es una medida adicional de bioseguridad; el objetivo de la vacunación es proteger a los animales sensibles del grupo después de la retirada de los animales con IP o para evitar la reintroducción de la infección en rebaños libres, especialmente en áreas en las que se sabe o percibe que el riesgo de introducir la infección por VDVB es alto.
- La segunda medida es la eliminación del virus mediante la eliminación de los animales con IP de los rebaños infectados.
- La vigilancia es fundamental para controlar el progreso de las intervenciones y para detectar rápidamente nuevas infecciones.
Autora: Camilla Luzzago, DVM, PhD. Profesora asociada de Enfermedades Infecciosas Animales. Departamento de Medicina Veterinaria y Ciencias Animales. Università degli Studi di Milano, Milán, Italia
Referencias bibliográficas:
1. Bauermann, F.V., Flores, E.F., Ridpath, J.F. (2012) Antigenic relationships between Bovine viral diarrhea virus 1 and 2 and HoBi virus: possible impacts on diagnosis and control. J Vet Diagn Invest 24:253–261. doi.org/10.1177/1040638711435144
2. Callan, R. J., & Garry, F. B. (2002). Biosecurity and bovine respiratory disease. The Veterinary Clinics of North America. Food Animal Practice, 18(1), 57–77. https://doi.org/10.1016/S0749-0720(02)00004-X
3. Caswell, J.L., Hewson, J. Slavić, D., DeLay, J., Bateman, K., (2012) Laboratory and Postmortem Diagnosis of Bovine Respiratory Disease Vet Clin North Am Food Anim Pract. 28(3): 419–441. doi: 10.1016/j.cvfa.2012.07.004
4. EFSA AHAW Panel (EFSA Panel on Animal Health and Welfare), More S, Bøtner A, Butterworth A, Calistri P, Depner K, Edwards S, Garin-Bastuji B, Good M, Gort_azar Schmidt C, Michel V, Miranda MA, Nielsen SS, Raj M, Sihvonen L, Spoolder H, Stegeman JA, Thulke H-H, Velarde A, Willeberg P, Winckler C, Baldinelli F, Broglia A, Dhollander S, Beltr_an-Beck B, Kohnle L and Bicout D (2017) Scientific Opinion on the assessment of listing and categorisation of animal diseases within the framework of the Animal Health Law (Regulation (EU) No 2016/429): bovine viral diarrhoea (BVD). EFSA Journal 2017;15(8):4952, 45 pp. https://doi.org/10.2903/j.efsa.2017.4952
5. Lindberg A, Brownlie J, Gunn GJ, Houe H, Moennig V, Saatkamp HW, Sandvik T and Valle PS, (2006). The control of bovine viral diarrhoea virus in Europe: today and in the future. Revue Scientifique et Technique (International Office of Epizootics), 25, 961–979.
6. Loneragan, G. H., Thomson, D. U., Montgomery, D. L., Mason, G. L., & Larson, R. L. (2005). Prevalence, outcome, and health consequences associated with persistent infection with bovine viral diarrhea virus in feedlot cattle. Journal of the American Veterinary Medical Association, 226(4), 595–601. https://doi.org/10.2460/javma.2005.226.595
Moennig, V.; Yarnall, M.J. (2021) The Long Journey to BVD Eradication. Pathogens, 10, 1292. https://doi.org/10.3390/pathogens10101292
Pardon, B. & Buczinski, S. (2020) Bovine Respiratory Disease Diagnosis What Progress Has Been Made in Infectious Diagnosis? Vet Clin Food Anim 36, 425–444 https://doi.org/10.1016/j.cvfa.2020.03.005
Sandvik, T., Greiser-Wilke, I., Graham, D. Genome, diagnosis & diagnostic tools (2006) EU Thematic network on BVDV control position paper
Schweizer, M., Stalder, H., Haslebacher, A., Grisiger, M., Schwermer, H., & Di Labio, E. (2021). Eradication of Bovine Viral Diarrhoea (BVD) in Cattle in Switzerland: Lessons Taught by the Complex Biology of the Virus. Frontiers in Veterinary Science, 8, 1012. https://doi.org/10.3389/fvets.2021.702730
Smith, R. A., Step, D.L., Woolums, A. (2020) Bovine Respiratory Disease Looking Back and Looking Forward, What Do We See? Vet Clin Food Anim 36, 239–251 https://doi.org/10.1016/j.cvfa.2020.03.009
Taylor, J. D., Fulton, R. W., Lehenbauer, T. W., Step, D. L., & Confer, A. W. (2010). The epidemiology of bovine respiratory disease: What is the evidence for predisposing factors? The Canadian Veterinary Journal, 51(10), 1095–1102.
Yeşilbağ, K., Alpay, G., Becher, P. (2017) Variability and Global Distribution of Subgenotypes of Bovine Viral Diarrhea Virus. Viruses 9:128. doi.org/10.3390/v9060128