El Complejo Respiratorio Bovino (CRB) es un gran problema en todo el mundo. Las estimaciones de costos alcanzan los 3 mil millones de dólares cada año para la industria ganadera1. Entre los patógenos implicados en el complejo, el virus respiratorio sincitial bovino (VRSB) se ha asociado con el 45 % de los casos de CRB2 (y el 60 % en caso de neumonía enzoótica de los terneros3). Estos números simples muestran por sí mismos la tremenda importancia del VRSB en la producción ganadera.

Enfermedad aguda
Visión general
Los efectos dañinos agudos de una cepa virulenta de VRSB que circula entre los terneros jóvenes pueden ser evidentes. Suelen notarse en el grupo de terneros con edades comprendidas entre los 1 y los 6 meses (aunque debe destacarse que la edad por sí sola no constituye un factor de protección). Si el ganado no ha tenido exposición previa, puede morir debido a las consecuencias de la infección a cualquier edad4). Esos efectos se manifiestan en forma de una enfermedad respiratoria contagiosa grave: la morbilidad puede llegar al 80 % de los terneros y la mortalidad al 20 %5. En la práctica, incluso la terapia más agresiva no tiene éxito en el tratamiento de los animales más afectados.
Especificidad del VRSB
Una enfermedad tan aguda y potencialmente mortal, que se observa con frecuencia con el VRSB, rara vez se observa con el PI-3. Sin embargo, estos dos virus inducen la necrosis de las células epiteliales de los bronquiolos. Así, el origen de las consecuencias letales de la infección por VRSB no se encuentra en su efecto citopático directo, sino en la capacidad del virus para desencadenar una inflamación aguda grave en todo el órgano.
Lesiones
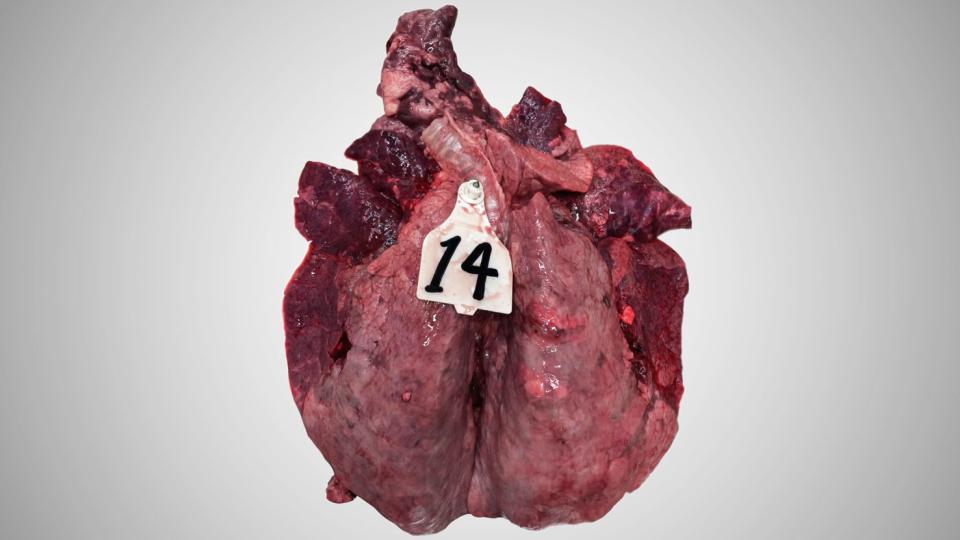
Macroscópicamente, esta inflamación presenta las características de una neumonía broncointersticial aguda con enfisema.
Los pulmones de los terneros que murieron después de una infección aguda por VRSB están muy congestionados. La congestión es irregular, lo que confiere un aspecto heterogéneo al parénquima. En la mayoría de los casos, la región anteroventral de los pulmones es la más congestiva y muestra algunas porciones atelectásicas. La reacción de los ganglios linfáticos siempre está presente y suele ser evidente, ya que la inflamación de los ganglios linfáticos puede exceder 10 veces el tamaño normal. El enfisema también es característico de la enfermedad.
Los exámenes histopatológicos revelan un claro daño de los bronquiolos: necrosis de las células epiteliales, presencia de grandes células sincitiales multinucleadas (que dieron nombre al virus), e infiltración mixta de neutrófilos y algunos eosinófilos (inusual en lesiones víricas clásicas). La necrosis epitelial también puede afectar a los neumocitos. Como consecuencia, a menudo se presenta reepitelización de la pared alveolar por neumocitos de tipo 2.
Patogenicidad
Aunque todavía hay muchas preguntas sobre la patogenicidad de la enfermedad, las publicaciones centradas en la enfermedad causada por Pneumovirus (el virus sincitial humano y bovino) indican que las peores evoluciones clínicas son inducidas por una inmunorreacción sesgada de Th25. Ese tipo de reacciones se aproximan a la hipersensibilidad de tipo I e implican la acción de la IgE, de los eosinófilos y a veces de los neutrófilos6. En los terneros, los neutrófilos parecen jugar un papel clave en esta patogenia7. El motivo por el que, en la misma manada, algunos animales desencadenan esta reacción inflamatoria perjudicial sesgada y otros no, sigue siendo una pregunta difícil. La respuesta depende de la relación hospedador-patógeno.
Por un lado, existen evidencias de que algunas cepas de virus son más capaces de provocar una inflamación grave. En el caso del VRSB, se identificó un pequeño péptido como uno de los actores clave de la reacción sesgada: la viroquinina8. Ha demostrado ser capaz de atraer eosinófilos (células fundamentales en la reacción Th2) y contraer los músculos lisos de los bronquios. Este último efecto es probablemente la explicación del enfisema grave característico de las lesiones pulmonares inducidas por el VRSB.
Por otro lado, en la patogenia del VRSB, el papel del hospedador no es secundario. Sobre el terreno, los brotes clínicos de VRSB resaltan la importancia del hospedador. De hecho, a diferencia de muchos otros patógenos, que inducen las enfermedades más agresivas en los animales más débiles, el VRSB a menudo mata a los animales más sanos. En las ganaderías de vacuno, por ejemplo, se ve con frecuencia que primero mueren los terneros “más bonitos”. Esta simple observación refleja el hecho de que tiene que estar presente una configuración especial del organismo del huésped para desencadenar la enfermedad y no solo una debilidad “clásica”.
Evolución crónica
Las consecuencias crónicas de la infección son mucho menos evidentes que la morbilidad y la mortalidad agudas y, a menudo, se subestiman.
Consecuencias a medio plazo
Las lesiones agudas mencionadas anteriormente reflejan la acción del virus en las células epiteliales de los bronquiolos y alvéolos. Sin embargo, el VRSB también tiene repercusiones graves en las células epiteliales traqueales. El epitelio ciliado de la tráquea, junto con las células caliciformes, forman una de las defensas innatas más eficientes del sistema respiratorio: el movimiento mucociliar. En condiciones fisiológicas, el movimiento mucociliar es una barrera mecánica que impide la colonización de las vías respiratorias por Pasteurellacea, la principal familia de bacterias patógenas en bovinos. Los experimentos muestran que en terneros sanos, el 90 % de las bacterias Pasteurella multocida introducidas experimentalmente en la tráquea se eliminan en 4 horas. Sin embargo, otros estudios señalan que el VRSB puede disminuir el aclaramiento mucociliar en un 50 %9. En esas condiciones, la barrera resulta mucho más fácil de cruzar para la microflora patógena nasofaríngea. Además, se cree que la mayor atracción de los neutrófilos10 durante la infección por VRSB aumenta el efecto de la leucotoxina de Mannheimia haemolytica (el principal factor de virulencia).
Por su acción perjudicial sobre el epitelio traqueal, el VRSB promueve en gran medida las infecciones bacterianas de los pulmones.
Consecuencias a largo plazo
Debido al alto nivel de exudación y daño tisular, las consecuencias crónicas a largo plazo de una infección bacteriana son claras. Para las infecciones víricas, la visión habitual es una fase aguda, que puede ser potencialmente mortal, seguida, si el animal sobrevive, de una recuperación completa. Esta concepción no es cierta con el VRSB.
La mejor ilustración de ello es el caso descrito por Klem et al.11. Los autores midieron los efectos a largo plazo de un brote de VRSB en un centro de pruebas de inseminación artificial. Gracias a los datos zootécnicos disponibles en el centro, se hicieron visibles las imperceptibles consecuencias de la infección. En comparación con el grupo "no clínico/no tratado", los toros que mostraron síntomas tenían una relación peso/edad constantemente más baja (4-10 %) durante el período de 8 meses del estudio. Pero, de manera más sorprendente, cuando el grupo "no clínico/no tratado" se comparó con un grupo comparable del año siguiente, este grupo “sano” tuvo una ganancia diaria reducida de 111g/día.
Este estudio muestra cuán dañino es un brote clínico de VRSB para la productividad del rebaño joven. Incluso en animales asintomáticos, una cepa virulenta de VRSB puede inducir lesiones a largo plazo que reducirán el rendimiento del ganado.
El origen de estas alteraciones a largo plazo es una lesión denominada bronquiolitis obliterante12. Se trata de una lesión inespecífica de los bronquiolos que puede ser inducida por el VRSB en un número muy elevado. Consiste en pequeños nódulos polipoides fibrosos que sobresalen en la luz de los bronquiolos y provocan una gran obstrucción. La consecuencia funcional es una caída en la eficiencia del intercambio de gases en los pulmones.
Conclusión
Las evidencias de las consecuencias deletéreas duraderas de los brotes de VRSB en animales sin exposición previa (además de las pérdidas obvias asociadas a los terneros que mueren a causa de la enfermedad) son las razones por las cuales la prevención es la única forma efectiva de abordar este problema.
Autor: Calixte Bayrou. Departamento Clínico de Animales de Producción, Facultad de Medicina Veterinaria, Universidad de Lieja
Bibliografía:
1. Watts, J. L. & Sweeney, M. T. Antimicrobial resistance in bovine respiratory disease pathogens: measures, trends, and impact on efficacy. Vet. Clin. North Am. Food Anim. Pract. 26, 79–88, table of contents (2010).
2. Brodersen, B. W. Bovine Respiratory Syncytial Virus. Vet. Clin. North Am. Food Anim. Pract. 26, 323–333 (2010).
3. Meyer, G., Deplanche, M. & Schelcher, F. Human and bovine respiratory syncytial virus vaccine research and development. Comp. Immunol. Microbiol. Infect. Dis. 31, 191–225 (2008).
4. Valarcher, J.-F. & Taylor, G. Bovine respiratory syncytial virus infection. Vet. Res. 38, 153–180 (2007).
5. Gershwin, L. J. Bovine respiratory syncytial virus infection: immunopathogenic mechanisms. Anim. Health Res. Rev. 8, 207–213 (2007).
6. Tizard, I. R. Veterinary Immunology. (Elsevier Health Sciences, 2012).
7. Hägglund, S. et al. Proteome analysis of bronchoalveolar lavage from calves infected with bovine respiratory syncytial virus—Insights in pathogenesis and perspectives for new treatments. PLOS ONE 12, e0186594 (2017).
8. Valarcher, J.-F. Bovine respiratory syncytial virus lacking the virokinin or with a mutation in furin cleavage site RA(R/K)R109 induces less pulmonary inflammation without impeding the induction of protective immunity in calves. J. Gen. Virol. 87, 1659–1667 (2006).
9. Gershwin, L. J., Gunther, R. A., Hornof, W. J. & Larson, R. F. Effect of infection with bovine respiratory syncytial virus on pulmonary clearance of an inhaled antigen in calves. Am. J. Vet. Res. 69, 416–422 (2008).
10. McGill, J. L. & Sacco, R. E. ɣ∂T cells and the immune response to respiratory syncytial virus infection. Vet. Immunol. Immunopathol. 181, 24–29 (2016).
11. Klem, T. B., Kjæstad, H. P., Kummen, E., Holen, H. & Stokstad, M. Bovine respiratory syncytial virus outbreak reduced bulls’ weight gain and feed conversion for eight months in a Norwegian beef herd. Acta Vet. Scand. 58, (2016).
12. Jubb, Kennedy & Palmer’s Pathology of Domestic Animals: Volume 2. (Elsevier, 2016). doi:10.1016/C2012-0-00823-X